姜黃素的臨床研究進展
蘇 旬1,賀秀麗2,劉秀菊3,郭京艷2,翟光喜1*
(1.山東大學藥學院,山東 濟南 250012;2.山東省醫科院附屬醫院藥劑科,山東 濟南 250031;3.山東省立醫院西院藥劑科,山東 濟南 250022)
摘 要:姜黃素具有廣泛的藥理活性,其作為治療多種疾病的潛力藥物的研究正越來越多的引起關注。多個臨床Ⅰ期試驗已證實,姜黃素口服安全且耐受性好;藥動學表明,姜黃素口服不易吸收,生物利用度低。研究顯示,姜黃素治療乳腺癌、結腸癌、腸易激綜合征、風濕性關節炎及動脈粥樣硬化等有療效。現總結了姜黃素臨床研究的報道,以冀為姜黃素的應用研究提供參考。
關鍵詞:姜黃素;臨床研究;抗炎;抗癌
中圖分類號:R979.1+4 文獻標識碼:A 文章編號:1672-979X(2012)05-0193-06
Progress of Clinical Research on Curcumin
SU Xun1, HE Xiu-li2, LIU Xiu-ju3, GUO Jing-yan2, ZHAI Guang-xi1 (1. School of Pharmaceutical Sciences, Shandong University, Jinan 250012, China; 2. Affiliated Hospital of Shandong Academy of Medical Sciences, Jinan 250031, China; 3. Shandong Provincial Hospital, Jinan 250022, China)
Abstract: Curcumin has been described as a potential agent for many diseases and is attracting much more attention due to its various pharmacological activities. Several phaseⅠtrials have demonstrated curcumin is well tolerated and safe. The pharmacokinetic studies of curcumin indicated in general a low bioavailability of curcumin following oral application. Extensive research has shown that curcumin has pharmacological efficacy in breast cancer, colon cancer, IBS, rheumatoid arthritis, atherosclerosis, and so on. This article summarized the related materials on clinical research of curcumin, and gave a review for application and study in the future.
Key Words: curcumin;clinical research;anti-inflammatory;anti-cancer
![]()
收稿日期:2011-05-12
基金項目:國家自然基金課題(30973646);山東省科技攻關課題(2010GWZ2020)
作者簡介:蘇旬(1987-),男,碩士研究生,研究方向為藥物新劑型E-mail: suxunz@yahoo.com.cn
*通訊作者:翟光喜,教授,從事藥物緩控釋、靶向給藥系統和生物醫學納米材料及生物藥物給藥系統研究制度,防止耐藥菌交叉感染,控制醫院感染的發生。 E-mail: zkyjd@sdu.edu.cn
參考文獻
[1] 賈輔忠.銅綠假單胞菌感染的預防和治療[J].中國實用內科雜志,1999,19(2):74-76.
[2] National Committee for Clinical Laboratory Standards (2004): Performance and standards for antimicrobial susceptibility testing[S]//Informational supplement M100-S12. NCCLS, Wayne.
[3] 賴福才,張豫明,耿穗娜,等.廣州地區銅綠假單胞菌藥敏監測結果分析[J].中華醫院感染雜志,2004,14(8):929-931.
[4] 蔣曉飛,倪語星.銅綠假單胞菌產生的超廣譜β-內酰胺酶[J].中華微生物學和免疫學雜志,2001,21(1):6-8.
[5] 柴棟,王睿,裴斐,等.藻酸鹽抗體的制備及其對銅綠假單胞菌生物被膜的影響[J].中華醫院感染學雜志,2004,(13):245-247.
[6] 曾吉,吳正學,郗娟,等.銅綠假單胞菌生物膜的抵抗性研究[J].中華醫院感染學雜志,2004,14(5):496-498.
[7] 明德松. 銅綠假單胞菌誘導型內酰胺酶的分類檢測及其臨床意義[J].中華醫院感染學雜志,2003,13(5):474-478.
[8] 李紅玉,潘昆貽,伍錫泉,等.1999~2003年廣州地區銅綠假單胞菌耐藥性變遷[J].中國醫院藥學雜志,2005,25(8):750-751.
[9] Magee J T, Pritchard E L, Fitzgerald K A, et al. Antibiotic prescribing and antibiotic resistance in community practice retrospective study [J].Br Med J, 1999, 31(6):1239 -1240.
藥姜黃具有破血行氣、通經止痛之功效,有效成分為姜黃素(curcumin)、脫甲氧基姜黃素及雙脫甲氧基姜黃素,姜黃素是其中主要有效成分[1]。姜黃素曾作為香料和食物色素廣泛用于食品工業[2],其結構式見圖1。近年,姜黃素的藥理活性不斷發現,如抗炎、清除自由基及抗癌等[3],其中一些藥理作用已進入臨床驗證階段。現將近年國內外有關姜黃素的臨床研究成果作一綜述,以期為姜黃素的應用與開發研究提供參考。
1 姜黃素在例體的藥動學特點及安全耐受性
Sharma等[4]通過15例結腸癌晚期患者口服姜黃提取物,研究姜黃素的藥動學。患者口服相當于姜黃素180 mg的提取物,HPLC測定血漿和尿液,幾乎未檢出姜黃素及其代謝產物,但在患者糞便中檢出姜黃素,表明患者每日口服姜黃素180 mg時,安全且耐受性好,但口服不易吸收,生物利用度低。Lao等[5]采用劑量比例遞增法(dose-escalation)研究姜黃素的最大耐受量和安全性,24例健康受試者口服姜黃素提取物粉末,劑量從500 mg依次增加至12 000 mg/次,只有7例出現輕微非劑量相關的毒性作用,故可認為姜黃素口服單劑量耐受性良好,可達8 000 mg。
Cheng等[6]對患5種惡性疾病的25例患者進行了臨床前瞻性研究,評估了姜黃素的安全性。開始給藥劑量為500 mg/d,若未出現連續的2級或2級以上的毒性反應,則劑量依次增加為1 000,2 000,4 000,8 000和12 000 mg/d。結果表明連續口服劑量8 000 mg/d姜黃素3個月,機體未出現與姜黃素相關的毒性反應; 3個月后,檢查患者病變組織,發現病變組織明顯改善。
2 臨床研究
2.1 姜黃素治療腸道疾病
2. 1.1 炎癥性腸病(inflammatory bowel disease,IBD)IBD又稱非特異性腸炎,廣義的IBD包括各種炎癥性腸病,如潰瘍性直腸炎;狹義一般是指克羅恩病(Crohn’sdisease)和潰瘍性結腸炎(ulcerative colitis,UC)。
Holt等[7]研究了姜黃素對潰瘍性直腸炎和克羅恩病的作用。5例潰瘍性直腸炎受試者試驗前都曾服用5-氨基水楊酸,姜黃素給藥550 mg/次,2 次/d,連續1月;隨后550mg/次,3 次/d,連續1月,分析受試者血液、生化及炎性指數。試驗結束時,5例患者癥狀均有改善,2例已不再服用5-氨基水楊酸,2例減少了5-氨基水楊酸藥量。5例克羅恩病受試者在用藥(5-氨基水楊酸或6-甲基強的松)的基礎上,姜黃素給藥360 mg/次,3 次/d,連續1月;隨后,360 mg/ 次,4 次/日。試驗結束時,所有受試者克羅恩病活動指數平均下降了55%,沉降率平均下降了10 mm/h,C反應蛋白下降了0.1 mg/dL,且對患者肝腎功能無明顯影響。該研究為開展大樣本隨機雙盲對照試驗提供了依據。
Hanai等[8]研究了姜黃素預防UC復發的能力。89例靜止期UC患者進行了隨機雙盲多中心試驗,其中43例除服用柳氮磺胺吡啶或美色拉嗪外,于早、晚餐后各服姜黃素1.0 g,余者服安慰劑,連續6個月。試驗初期、每隔2個月及試驗結束時,檢查受試者的臨床活性指數(CAI)和內鏡指數(EI)。結果姜黃素組2例出現復發(4.65 %);安慰劑組8例復發(20.51 %),表明姜黃素與安慰劑預防UC復發率明顯不同,姜黃素能明顯改善患者CAI和EI,抑制UC發病率。
2.1.2 腸易激綜合征(irritate bowel syndrome,IBS) IBS是一種常見功能性腸道疾病,其特征多為腹痛、腹脹、便秘或腹瀉等。Bundy等[9] 隨機將207例受試者分成2組,一組每日服用姜黃根提取物1片,另一組服用2片,試驗8周后,兩組IBS發病率分別降低53%和60%,治療后IBS癥狀顯著解,兩試驗組無明顯差異。
Shimouchi等[10]研究了姜黃素類物質對腸蠕動的影響。選定8例健康受試者分成兩組,試驗組隨食物攝入含姜黃素的咖喱粉,對照組則不進含姜黃素的咖喱粉;每隔15 min測定呼出氣體中的氫含量,連續6 h。兩組比較,試驗組呼出氣中氫含量顯著增加,且小腸通過時間縮短,表明姜黃素類物質能增加腸蠕動,促進糖類在結腸中的發酵作用。
2.2 促進例體膽囊收縮
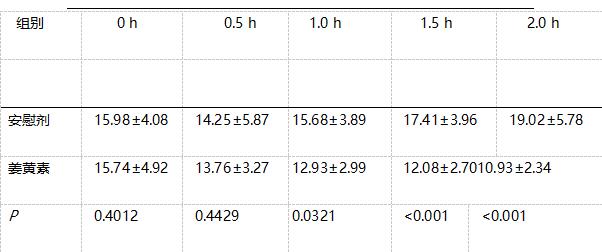
Rasyid 等[ 1 1 ]為比較姜黃素和安慰劑對健康例體膽囊的作用。將12 例受試者分為兩組進行隨機雙盲交叉研究,在給予姜黃素或安慰劑前空腹膽囊容積分別為( 15.74±4.29)mL和(15.98±4.08)mL,二者相似;分別給予20 mg姜黃素或相同量安慰劑后0.5,1.0, 1.5 和2 . 0 h 測量膽囊容積,姜黃素組膽囊容積分別降低了( 11.8±6.9)%,(16.8±7.4)%,(22.0±8.5)%,( 2 9 . 3 ±8 . 3 )% ,安慰劑組在0 . 5 h 后顯著下降,約( 10.9±22.8)%,1.0 h后膽囊容積開始增加,相關試驗數據見表1,試驗表明,姜黃素能夠誘使例體膽囊發生收縮。
Rasyid [12]還研究了膽囊收縮50 %時所需姜黃素的量及姜黃素用量與膽囊收縮的線性關系,結果表明姜黃素劑量對膽囊收縮作用有顯著差異,在試驗基礎上確定使膽囊容積收縮50 %所用姜黃素的量為40 mg,但無數據證明膽囊收縮量與姜黃素劑量呈線性關系。
表1 服用20 mg姜黃素和安慰劑后膽囊容積/mL
2.3 對例體血脂水平的影響
例體血脂異常是導致高血脂、動脈硬化等心血管疾病的重要原因。Soni等[13]研究了姜黃素對例體血清膽固醇和脂質過氧化物的作用,10例受試者每日給予姜黃素500 mg,連續7 d,一周后發現血清中總膽固醇下降了11.63 %,高密度脂蛋白上升了29 %,脂質過氧化物下降了33 %,認為姜黃素對降低膽固醇有積極作用。而Bauma等[14]的試驗得到了不同的結果。將36例分成安慰劑組、姜黃素給藥1 g/d、g/d試驗組,隨機雙盲對照試驗。在消除各組差異后,于用藥初、1個月、6個月分別測量3組受試者血清總膽固醇、HDL膽固醇、LDL膽固醇及甘油三酯含量變化并比較,發現姜黃素給藥組無組間差異,與安慰劑組之間亦無顯著差異,認為姜黃素無降低血清膽固醇的作用。Alwi等[15] 通過63例急性冠脈綜合征受試者研究了不同劑量姜黃素對膽固醇的影響,得到了與Bauma類似的結果。
2.4 抗癌作用
癌癥是一種過度增生性疾病,姜黃素能阻斷癌細胞轉化、增殖及侵襲,作為抗癌藥物,在結直腸癌,乳腺癌、胰腺癌、淋巴性白血病及前列腺癌等治療方面,具有廣闊的前景[16]。
2.4.1 結直腸癌 Sharma等[17]將15例經用標準療法無效的中晚期結直腸癌病例分成4個姜黃素劑量組,最小劑量0.45g/d,最大劑量為3.6 g/d,通過檢測血液中谷胱甘肽S轉移酶、PG E2、M1G含量變化反映姜黃素的作用,其中,3.6 g/d劑量組,在第1和第29日,誘導型PG E2分別降低了62 %和57 %。Garcea等[18]給予結直腸癌受試者姜黃素3.6 g/d,連續7 d,于給藥初及最后一次服藥6~7 h后,分別檢查正常和病變結直腸組織,發現二者姜黃素濃度分別為(12.7±5.7)和(7.7±1.8) nmol/g,同時M1G顯著下降。
2.4.2 胰腺癌 Dhillon等[19]在Ⅱ期臨床試驗中以白細胞介素IL-6、IL-8、IL-10等細胞因子為指標,研究了姜黃素對胰腺癌的作用。受試者每日口服姜黃素8 g, 連續2個月,若受試者出現療效則按相同方法繼續試驗。對其中11例受試者進行藥效學評價,結果表明,姜黃素對胰腺癌有生物活性,其中1例病情穩定長達18個月,另1例腫瘤曾出現短暫且明顯消退。由于目前美國FDA批準上市的用于治療該病的吉西他濱、厄洛替尼有效率<10%, 因此,有關姜黃素對胰腺癌治療的研究有巨大的空間。
2.4.3 皮膚T細胞淋巴瘤 Zhang等[20]研究了姜黃素對皮膚T細胞淋巴瘤(CTCL)細胞和來自CTCL患者外周血單核細4胞(PBMCs)的抗癌活性。用濃度5~20 μmol/L姜黃素培養CTCL細胞24 h和48 h,其誘導3種CTCL細胞凋亡且呈時間劑量依賴關系;同時用濃度為5~20 μmol/L的姜黃素培養PBMCs 48 h,與健康捐贈細胞相比,姜黃素更能誘導CTCL患者外周血單核細胞凋亡。試驗表明通過負調節CTCL細胞中的STAT-3和NF-κB信號途徑,姜黃素能選擇性地誘導細胞凋亡,為姜黃素可能作為治療皮膚T細胞淋巴瘤藥物提供了藥理機制基礎。
2.4.4 多發性骨髓瘤 Bharti[21-22]分析評價了22例多發性骨髓瘤(multiple myeloma,MM)患者骨髓CD138+細胞,并用免疫細胞化學法檢測了NF-κB和STAT3活性,試驗發現,所有患者MM細胞都能表達活性的NF-κB和STAT3,健康受試者細胞中則不存在。體外經姜黃素治療后,MM細胞中
NF-κB和STAT3活性受到抑制,MM細胞存活率下降;此外,在抑制NF-κB和STAT3活性和誘導MM細胞凋亡的效果上,姜黃素優于地塞米松,表明姜黃素在治療多發性骨髓瘤上具有潛力。
2.4.5 慢性B型淋巴細胞性白血病 姜黃素能抑制NIK/IKK復合物,具有誘導原發性慢性淋巴細胞性白血病(B-CLL)細胞凋亡的活性。Everett等[23]在培養基中加入不同量姜黃素培養原代白血病細胞,然后評價其凋亡。取14例患者的B-CLL細胞,姜黃素誘導其凋亡的半數有效濃度(EC50)為5.5 μmol/L,來自健康捐贈者的單核細胞,其EC50為21.8μmol/L。在48 h的排藥時間間隔期間,姜黃素誘導的細胞凋亡呈時間相關性,姜黃素被清除5 h后,誘導凋亡的能力顯著下降。
2.4.6 乳腺癌 除研究單獨使用姜黃素治療某些癌癥的作用外,一些抗癌藥物聯合姜黃素增加抗癌作用的臨床研究也在進行。Robert等[24]通過14乳腺癌患者參與的Ⅰ期臨床試驗研究了姜黃素與多西紫杉醇聯合應用的可行性及耐受性。多烯紫杉醇每3周靜脈滴注100 mg/m2,每次給藥時間1h,循環6次;姜黃素口服給藥,根據循環,劑量從500 mg/d 依次增加直至出現劑量限制毒性為止,每一劑量連續7 d。研究確定姜黃素最大劑量為8 g/d,在與標準劑量多烯紫杉醇聯合應用時,推薦每3周連續服用姜黃素7 d,每日600 mg。目前單獨應用多烯紫杉醇和多烯紫杉醇聯合姜黃素治療乳腺癌的Ⅱ期臨床試驗正在進行。
2. 4.7 前列腺癌 持續的前列腺炎癥易致前列腺癌發生,較高水平的前列腺特異性抗原(prostate-specific antigen,PSA)能夠反映前列腺炎癥狀況,介入治療改善PSA水平對預防前列腺癌的發生具有有益作用。Ide等[25]研究了異黃酮類和姜黃素對前列腺癌細胞(LNCaP)的作用,且進行了臨床試驗評價兩者對血中PSA水平的影響。在大豆異黃酮和姜黃素治療前后,檢測LNCaP細胞中雄激素受體的表達和PSA;發現治療后,LNCaP細胞中PSA生成顯著下降。
隨機將85例受試者分成兩組進行雙盲試驗,根據受試者血中PSA水平,以10 ng/mL為界分成2組。1組(PSA≤10 ng/ mL):安慰劑32例,給藥28例;2組(PSA>10 ng/mL):安慰劑10例,給藥15例,試驗6個月。2組給藥的15例其PSA顯著下降,由治療前的(18.8±12.4) ng/mL降至治療后的(10.2±6.2) ng/mL,見表2。表明姜黃素和大豆異黃酮能通過抗雄激素作用,抑制前列腺細胞中PSA產生,調節血中PSA水平。
表 2 患者特征及PSA水平

2.4.8 家族多發性腺癌 家族多發性腺癌(familial adenomatous polyposis,FAP)是一種常見染色體顯性疾病,通常使用非甾體抗炎藥和COX-2抑制劑治療。Cruz-Correa等[26]報道了聯合應用姜黃素和槲皮素治療FAP的效果。5例先前做過結腸切除術的FAP病例口服姜黃素480 mg、槲皮素20 mg,每日3次,連續6個月,受試者腸道息肉的數量和大小均下降,平均降低依次為60.4 %和50.9 %(P<0.05),表明姜黃素和槲皮素聯合應用能夠降低FAP患者回腸和直腸內腺瘤的數量及大小。
2.5 抗炎作用
Durgaprasad等[27]聯合應用姜黃素和胡椒堿緩解慢性熱帶胰腺炎(tropical pancreatitis,TP),20例連續TP患者隨機分成2組,一組給予純度為95 %的姜黃素500 mg和胡椒堿5 mg,一組僅給安慰劑,每日3次,連續6周,評價病例疼痛程度及紅細胞中丙二酰二醛(MDA)和谷胱甘肽(GSH)水平。經過治療,與安慰劑相比,紅細胞中MDA水平明顯下降;同時GSH水平增加,表明聯合應用姜黃素和胡椒堿能夠有效地逆轉TP患者脂質過氧化反應,有助于緩解熱帶胰腺炎癥狀。
2.6 對DNA和細胞的保護作用
Biswas[28]選取286例受試者,研究姜黃素對砷誘導引起的DNA損傷的保護作用。將受試者隨機分成2組,一組口服姜黃素及胡椒堿(20:1)500 mg,每日2次,連續3個月,胡椒堿主要用于提高姜黃素的生物利用度;另一組給予安慰劑作為對照。經治療后,試驗組DNA損傷降低,活性氧形成和脂質過氧化作用被抑制,表明姜黃素有保護由砷引起DNA損傷的作用。
2.7 其它疾病
Ng等[29]通過比較亞洲例對食用富含姜黃素的咖喱粉頻率,研究了姜黃素對病例認知功能的影響,認為常食用富含姜黃素的食物能夠改善患者的認知功能。Ringman等[30]認為姜黃素在預防治療阿爾茨海默病有著良好的前景。
Lal等[31]研究了姜黃素治療慢性葡萄膜炎的作用,隨機將32例受試者分成2組,一組18例僅接受姜黃素,每日3次,每次375 mg;另一組除姜黃素外還接受抗結核藥物治療,連續12周。結果僅服用姜黃素的病例都得到好轉,另一組好轉率為86 %,在接下來的隨訪中發現,第一組復發率為55 %,第二組為36 %,表明姜黃素具有藥效作用。
Golombick等[32]利用安慰劑對照交叉試驗法檢測了姜黃素對意義未定的單克隆丙種球蛋白病(MGUS)患者漿細胞和破骨細胞的作用。將26例受試者隨機分成2組,一組于飯前1 h或飯后0.5 h口服姜黃素,2 g/次,2次/d,另一組口服安慰劑,連續3個月,隨后交叉試驗,進行6個月。3個月的試驗結束后,對于血清副蛋白水平較高(>20 g/L)的10例中5例(50 %)血清副蛋白降低了12%~30%,低于20 g/L的患者,治療期間水平穩定;27 %受試者的Ⅰ型膠原蛋白N端肽降低了25%,安慰劑組在治療期間基本不變,交叉試驗后,則有2例的Ⅰ型膠原蛋白N端肽分別降低了12.5%和15%。
Kalpravidh等[33]對21例β地中海貧血病患者進行了為期12個月的試驗,研究了姜黃素類化合物對該病的改善作用。受試者每日口服給藥500 mg,連續12個月;治療期間,每隔2個月取血1次,停藥3個月后,再取血檢測患者超氧化物歧化酶(SOD)和還原型谷胱甘肽(GSH)等相關指標。治療前患者SOD水平較高,GSH水平低,患者氧化應激作用較強;堅持給藥后,以上指數改善,但停藥3個月后,指標參數又重新回到開始水平,表明堅持服用姜黃素類物質,能夠改善β地中海貧血病患者由于氧化性應激帶來的損傷。
此外,Ovbiagele[34]還研究了姜黃素抗休克的機制,認為姜黃素對神經具有保護作用;Burns等[35]研究了姜黃素對進行性肥大性間質性神經病的治療作用。
2.8 正在進行的臨床研究
目前有關姜黃素的臨床研究十分活躍,正在進行或將要開展的臨床試驗較多,如特應性哮喘、Ⅱ型糖尿病、多發性骨髓瘤等,其中一些研究進展迅速,如處于臨床Ⅱ期的乳腺癌試驗、Ⅱ期的結直腸癌試驗、Ⅲ期的Leber氏遺傳性視神經病試驗等,因此相關研究需密切關注。表3為美國臨床試驗網提供的有關姜黃素臨床研究的進展情況。
表3 姜黃素部分臨床研究狀況
|
研究內容 |
臨床試驗 |
研究進度 |
|
|
|
|
|
結腸癌 |
Ⅰ,Ⅱ,Ⅲ期 |
已完成 |
|
慢性銀屑病 |
Ⅱ期 |
已完成 |
|
胰腺癌 |
Ⅲ期 |
已完成 |
|
腸易激綜合征 |
Ⅳ期 |
正在進行 |
|
皮膚T細胞淋巴瘤 |
Ⅱ期 |
即將進行 |
|
家族多發性腺癌 |
Ⅱ期 |
已終止 |
|
乳腺癌 |
Ⅱ期 |
正在進行 |
|
輻射性皮炎 |
Ⅱ,Ⅲ期 |
正在進行 |
|
阿爾茨海默病 |
Ⅰ,Ⅱ期 |
已完成 |
|
囊性纖維化 |
Ⅰ期 |
已完成 |
|
頭頸癌 |
Ⅰ,Ⅱ期 |
即將進行 |
|
|
3 展望
過去50年內對姜黃素的大量研究表明,姜黃素有廣泛的藥理活性,特別是在抗氧化及抗癌等方面有重大的應用潛力。由于姜黃素水中溶解度小,口服難吸收,且在腸道吸收過程中易轉化,其代謝產物進入漿膜,然后以葡糖苷酸結合物或硫酸結合物的形式進入全血循環,降低了生物利用度,限制了其在臨床的應用。
聯合用藥是提高姜黃素生物利用度的一種途徑,姜黃素與胡椒堿或槲皮素聯合應用能大大提高單獨使用姜黃素時的生物利用度,縮短達到最大血藥濃度的時間。利用現代制劑新技術,能有效地增加姜黃素穩定性,提高其生物利用度,如將姜黃素載入微囊或脂質體等新型給藥載體,能夠有效地提高姜黃素的生物利用度。改變給藥途徑,如做成注射劑或將姜黃素制成靶向制劑,亦能提高姜黃素生物利用度,最大限度的發揮藥效。
隨著更深入合理臨床研究的不斷深入及現代制劑新技術的不斷發展,相信姜黃素必將作為一種新型藥物給患者帶來福音。
參考文獻
[1] 賈紹華,張舜堯. 姜黃素藥理作用研究進展[J]. 中國現代藥物應用, 2009, 3(22):188-189.
[2] Epstein J, Sanderson I R, Macdonald T T. Curcumin as a therapeutic agent: the evidence from in vitro, animal and human studies [J]. Br J Nutr, 2010, 9(1):8-14.
[3] Goel A, Kunnumakkara A B, Aggarwal B B. Curcumin as “Curecumin”: From kitchen to clinic [J]. Biochem Pharmacol, 2008, 75(4):787-809.
[4] Sharma RA, Hill H R, Ireson C R. Pharmacodynamic and pharmacokinetic study of oral curcuma extract in patients with colorectal cancer[J]. Clin Cancer Res, 2001, 7(7): 1894-1900.
[5] Lao C D, Ruffin M T, Normolle D, et al. Dose escalation of a curcuminoid formulation[J]. BMC Complement Altern Med, 2006, 6:10.
[6] Cheng A L, Hsu C H, Lin J K, et al. Phase Ⅰ clinical trial of curcumin, a chemopreventive agent, in patients with high-risk or pre-malignant lesions[J]. Anticancer Res, 2001, 21(4B): 2895-2900.
[7] Holt P R, Katz S, Kirshoff R. Curcumin therapy in inflammatory bowel disease: a pilot study[J]. Dig Dis Sci, 2005, 50(11):2191-2193.
[8] Hanai H, Iida T, Takeuchi K, et al. Curcumin maintenance therapy for ulcerative colitis: randomized, multicenter, double- blind, placebo-controlled trial[J]. Clin Gastroenterol Hepatol, 2006 , 4(12):1502-1506.
[9] Bundy R, Walker A F, Middleton R W, et al . Turmeric extract may improve irritable bowel syndrome symptomology in otherwise healthy adults: a pilot study[J]. J Altern Complement Med, 2004, 10 (6):1015-1018.
[10] Shimouchi A, Nose K, Takaoka M, et al. Effect of dietary turmeric on breath hydrogen[J]. Dig Dis Sci, 2009, 54(8): 1725-1729.
[11] Rasyid A, Lelo A . The effect of curcumin and placebo on human gall-bladder function: an ultrasound study[J]. Aliment Pharmacol Ther, 1999, 13(2):245-249.
[12] Rasyid A, Rahman A R A, Jaalam K, et al. Effect of different curcumin dosages on human gall bladder[J]. Asia Pacific J Clin Nutr, 2002 , 11(4): 314-318.
[13] Soni K B, Kuttan R. Effect of oral curcumin administration on serum peroxides and cholesterol levels in human volunteers[J]. Indian J Physiol Pharmacol, 1992, 36(4):273-275.
[14] Bauma L, Stanley K K, Vincent C T, et al. Curcumin effects on blood lipid profile in a 6-month human study[J]. Pharmacol Res, 2007, 56(6):509-514.
[15] Alwi I, Santoso T, Suyono S, et al. The effect of curcumin on lipid level in patients with acute coronary syndrome[J]. Acta Med Indones, 2008, 40(4):201-210.
[16] Shishodia S, Chaturvedi M M, Aggarwal B B. Role of curcumin in cancer therapy[J]. Curr Probl Cancer, 2007, 31(4):243-305.
[17] Sharma R A, Euden S A, Platton S L, et al. Phase I clinical trial of oral curcumin: biomarkers of systemic activity and compliance[J]. Clin Cancer Res, 2004, 10(20): 6847-6854.
[18] Garcea G, Berry D P, Donald J L, et al. Consumption of the putative chemopreventive agent curcumin by cancer patients: assessment of curcumin levels in the colorectum and their pharmacodynamic consequences[J] . Cancer Epidemiol Biomarkers Prev, 2005, 14(1):120-125.
[19] Dhillon N, Aggarwal B B, Robert A N, et al. Phase II trial of curcumin in patients with advanced pancreatic cancer [J]. Clin Cancer Res, 2008, 14(14):4491-4499.
[20] Zhang C L, Li B Q, Zhang X, et al. Curcumin selectively induces apoptosis in cutaneous T-cell lymphoma cell lines and patients’ pbmcs: potential role for stat-3 and NF-κB signaling[J]. J Invest Dermatol, 2010, 130(8):2110-2119.
[21] Bharti A C, Donato N, Singh S, et al. Curcumin (diferuloylmethane) down-regulates the constitutive activation of nuclear factor–κB and IκBα kinase in human multiple myeloma cells, leading to suppression of proliferation and induction of apoptosis[J]. Blood, 2003, 101(3):1053-1062.
Bharti A C, Shishodia S, Reuben J M, et al. Nuclear factor-κB and STAT3 are constitutively active in CD138+ cells derived from
multiple myeloma patients, and suppression of these transcription factors leads to apoptosis[J]. Blood, 2004, 103(8):3175-3184.
[23] Everett P C, Meyers J A, Makkinje A, et al. Preclinical assessment of curcumin as a potential therapy for B-CLL[J]. Am J Hematol, 2007 , 82(1):23-30.
[24] Robert B M, Kwiatkowski F, Leheurteur M, et al. Phase I dose escalation trial of docetaxel plus curcumin in patients with advanced and metastatic breast cancer[J]. Cancer Biol Ther, 2010, 9(1):8-14.
[25] Ide H, Tokiwa S, Sakamaki K, et al. Combined inhibitory effects of soy isoflavones and curcumin on the production of prostate-specific antigen[J]. The Prostate, 2010, 70(10): 1127-1133.
[26] Cruz-Correa M, Shoskes D A, Sanchez P, et al. Combination treatment with curcumin and quercetin of adenomas in familial adenomatous polyposis[J]. Clin Gastroenterol Hepatol, 2006, 4
(8):1035-1038.
[27] Durgaprasad S, Ganesh P C, Vasanthkumar, et al. A pilot study of the antioxidant effect of curcumin in tropical pancreatitis[J]. Indian J Med Res, 2005, 122(4):315-318.
[28] Biswas J, Sinha D, Mukherjee S, et al. Curcumin protects DNA damage in a chronically arsenic-exposed population of West Bengal[J]. Hum Exp Toxicol, 2010, 29(6): 513-524.
[29] Ng T P, Chiam P C, Lee T, et al. Curry consumption and cognitive function in the elderly[J]. Am J Epidemiol, 2006, 164(9): 898-906.
[30] Ringman J M, Frautschy S A, Gregory M C, et al. A potential role of the curry spice curcumin in Alzheimer’s disease[J]. Curr Alzheimer Res, 2005, 2(2): 131–136.
[31] Lal B, Kapoor A K, Asthana O P, et al. Efficacy of curcumin in the management of chronic anterior uveitis[J]. Phytother Res, 1999, 13(4):318-322.
[32] Golombick T, Terrence H D, Vladimir B, et al. The potential role of curcumin in patients with monoclonal gammopathy of undefined significance—its effect on paraproteinemia and the urinary n-telopeptide of type I collagen bone turnover marker[J]. Clin Cancer Res, 2009, 15(18): 5917-5922.
[33] Kalpravidh R W, Siritanaratkul N, Insain P, et al. Improvement in oxidative stress and antioxidant parameters inβ-thalassemia/Hb E patients treated with curcuminoids[J]. Clin Biochem, 2010, 43(4-5):424-429.
[34] Ovbiagele B. Potential role of curcumin in stroke prevention [J]. Expert Rev Neurother, 2008, 8(8): 1175-1176.
[35] Burns J, Joseph, MPharm P D, et al. Effect of oral curcumin on De′je′rine-Sottas disease[J]. Pediatr Neurol, 2009, 41(4): 305-308.